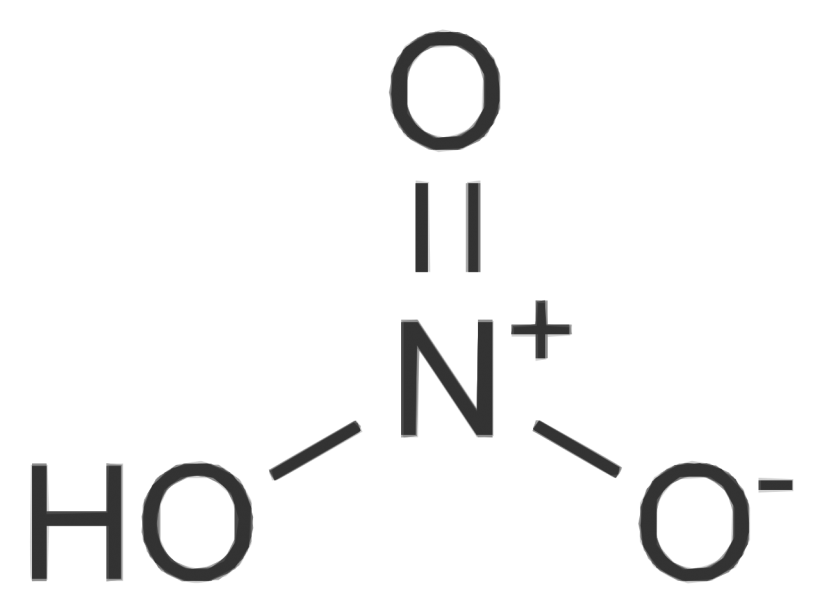
El ácido nítrico es un compuesto químico que pertenece al grupo de ácidos inorgánicos, conocido por ser extremadamente corrosivo y altamente tóxico. Es uno de los oxácidos derivados del nitrógeno que se obtiene de la mezcla de este último con el agua y fue descubierto por el alquimista Jabir ibn Hayyan en el año 1648 mientras quemaba una mezcla de alumbre, nitro y sulfato de cobre.
Actualmente es uno de los más utilizados a nivel industrial, uno de los oxácidos más importantes del nitrógeno y quizás el segundo más importante de todos los ácidos inorgánicos. Es un líquido viscoso y aceitoso, incoloro y que por efecto o acción de la luz puede tomar una coloración amarillosa o marrón más o menos intensa como consecuencia de su proceso de descomposición. Soluble en el agua en cualquier proporción y cantidad.
Usos del ácido nítrico.
El ácido nítrico es utilizado comúnmente en:
- Procesos de fabricación de abono y fertilizantes agrícolas
- Fabricación de explosivos
- Grabados artísticos
- Oxidación de oro y platino
- Joyería
- Fabricación de protectores de metales
- Fabricación de productos de limpieza
- Neutralización durante el tratamiento de aguas residuales
- Elaboración de tópicos dermatológicos.
- Cura de padecimientos o enfermedades de animales.
- Elaboración de poliuretanos para la fabricación de espumas, pinturas y selladores de diversas superficies.
- Preparación de la nitroglicerina para tratamientos médicos
Propiedades del ácido nítrico.
- Consistencia: viscoso y aceitoso.
- Color: en estado puro es incoloro y bajo los efectos o acción de la luz puede tornarse marrón como consecuencia de su descomposición.
- Soluble en el agua en cualquier proporción o cantidad.
- Olor: altamente irritante y fuerte
- Se descompone creando agua, nitrógeno y dióxido de nitrógeno.
- Altamente corrosivo y muy tóxico, que ataca la gran mayoría de los metales, salvo oro y platino.
- Genera explosiones al establecer contacto con polvos metálicos, carburos y sulfuro de hidrogeno.
- Impide la corrosión de otros elementos químicos en metales como el cromo y aluminio.
- En reacción con óxidos o sustancias básicas origina sales y facilita la combustión en la madera y gasolina, sin llegar a ser inflamable.
- Efecto nitrificante en materias orgánicas al estar concentrado.
- Efecto oxidante en materias orgánicas al estar diluido.
- Causa gases tóxicos al entrar en contacto con sustancias tales como acetona, ácido acético, alcoholes y trementina.